- Как сделать химическую грелку своими руками
- Опасна ли химическая грелка и как ее сделать своими руками.
- А теперь о том, как не надо делать химическую грелку.
- Особенности предлагаемой автором грелки из медного купороса.
- 2 комментария
- Как сделать химическую грелку своими руками
- Химическая грелка своими руками
- Библиографическое описание:
Как сделать химическую грелку своими руками
В походе, на рыбалке, особенно в непогоду часто возникает нужда в обыкновенной грелке. Конечно, неплоха и обычная резиновая, но у нее есть один существенный недостаток: очень уж медленно греется для нее на костре вода. Попробуем сделать химическую грелку. Для этого нам понадобятся самые обычные реактивы.
В походе, на рыбалке, особенно в непогоду часто возникает нужда обыкновенной грелке. Конечно, неплоха и обычная резиновая, но у нее есть один существенный недостаток: очень уж медленно греется для нее на костре вода.
Попробуем сделать химическую грелку. Для этого нам понадобятся самые обычные реактивы.
Для начала проведем несложный опыт. Пойдите на кухню и возьмите пачку поваренной соли. Впрочем, пачка не понадобится. Достаточно будет 20 г (2 чайных ложки). Затем загляните в шкафчик, где хранятся всевозможные хозяйственные препараты и материалы. Наверняка там сохранилось после ремонта квартиры немного медного купороса. Его понадобится 40 г (3 чайных ложки). Древесные опилки и кусок алюминиевой проволоки, надо полагать, тоже найдутся. Если так, все готово. Разотрите в ступке купорос и соль так, чтобы величина кристаллов не превышала 1мм (разумеется, на глаз). В полученную смесь добавьте 30 г (5 столовых ложек) древесных опилок и тщательно перемешайте.
Откуда берется в банке тепло, и какую роль играет каждый из компонентов? Обратимся к уравнению реакции:
В результате взаимодействия медного купороса с поваренной солью образуется сульфат натрия и хлорная медь. Именно она нас интересует. Если вычислить тепловой баланс реакции, то окажется, что при образовании одной грамм-молекулы хлорной меди выделяется 4700 калорий тепла. Плюс теплота растворения в исходных образующихся препаратов — 24999 калорий. Итого: примерно 29600 калорий.
Тотчас же после образования хлорная медь вступает во взаимодействие с алюминиевой проволокой:
При этом выделяется (также в пересчете на 1 г-моль хлорной меди) примерно 84000 калорий.
Как видите, в результате процесса суммарное количество выделяющегося тепла превышает 100000 калорий на каждую грамм-молекулу вещества. Так что никакой ошибки или обмана нет: грелка самая настоящая.
А что же опилки? Не принимая никакого участия в химических реакциях, они в то же время играют очень важную роль. Жадно впитывая в себя воду, опилки замедляют течение реакций, растягивают работу грелки во времени. К тому же древесина обладает достаточно низкой теплопроводностью: она как бы аккумулирует выделяющееся тепло и затем постоянно отдает его. В плотно закрытой посуде тепло сохраняется, по меньшей мере, два часа.
И последнее замечание: банка, конечно, не лучший сосуд для грелки. Она понадобилась нам только для демонстрации. Так что сами подумайте над формой и материалом для резервуара, в который поместить греющую смесь.
Источник: журнал «Юный техник», №5, 1983г
Понравилась статья? Подпишитесь на канал, чтобы быть в курсе самых интересных материалов
Источник
Опасна ли химическая грелка и как ее сделать своими руками.
В сети можно найти немало разработок самодельных химических грелок для рыболовов и туристов. Работа грелки основана на химической реакции с участием воды, соли, алюминия и медного купороса. Грелка используется для отогревания окоченевших пальцев рук на рыбалке. Можно с помощью нее разогреть остывшую пищу.
Надо признать, что реактивы не из дешевых сейчас, возможно проще и выгодней взять каталитическую грелку, одной заправки хватает на 6-8 часов работы, после 200-300 применений просто меняется платиновый элемент. Но, как утверждает автор разработки, которую мы рассматриваем, у китайской каталитической грелки есть свои минусы. Если попадется хилый китай, то катализатора хватит на неделю. К тому же, такая грелка чувствительна к температуре. В наружном кармане корпус остывает, топливо перестает испарятся и грелка без топлива перестает выдавать тепло. Капризная она в этом плане. Даже чехол не спасает. А уж если ее замерзшими руками взять, то совсем быстро остынет.
Какой алюминий использован в грелке? Пищевая фольга. Ширина 28 см, длина 20 см, толщина 14 мкм. Соотношение медного купороса и кухонной соли 2:1. В пробку вклеен бамбуковый шампур на термоклей.
В эксперименте очень холодная вода. Смесь нагревается до комнатной температуры за счет растворения безводного медного купороса. Взбалтываем бутылочку со смесью для ускорения химической реакции. Фольга на шампуре будет равномерно нагревать жидкость в бутылке. В ходе реакции будет выделяться водород и тепло, которое ускорит реакцию. Давление в бутылке нужно контролировать и постоянно стравливать водород. Алюминий растворяется а из раствора выделяется медь. Если в течение минуты газ не выделяется, значит реакция закончилась. В принципе воду можно даже вскипятить, но такого нагрева не выдержит бутылка.
А теперь о том, как не надо делать химическую грелку.
Желая свести время реакции к минимуму, автор видео решил увеличить площадь контакта алюминия. С этой целью он измельчил алюминиевые пластинки. Далее, как обычно заложил в бутылку в нужной пропорции соль и медный купорос. Залил водой. Размешал. Закинул алюминиевую болванку и закрутил крышку. Приоткрыв крышку, чтобы стравить водород, он получил заряд с грязной горячей жидкостью на себя.
Посмотрите на видео эксперимент, показывающий химическую реакцию, лежащую в основе грелки и как ее сделать своими руками. Ну, а если вы хотите увидеть сразу, “во что вылилось” нарушение технологии, то есть об опасностях химических грелок, то с момента 3:41.
Особенности предлагаемой автором грелки из медного купороса.
Подобный рецепт кочует по сети не один десяток лет, но в нем все сводится к смешиванию солей, добавлению опилок, алюминия и воды. И при этом не
ясно как регулировать скорость реакции, температуру грелки и как отводить выделяющиеся газы. Автор выбрал простой путь. Короткая, но активная химическая реакция дает тепло, которое удерживает смесь солей. Это позволяет экономить реактивы и удерживать температуру в комфортном диапазоне.
По мере остывания грелки можно добавлять новые порции алюминия.
Скорость химической реакции зависит от концентрации, температуры и площади поверхности реагирующих веществ. Поэтому алюминий в виде фольги, а не проволоки, труб, уголков и прочего. Т.к. концентрация солей в процессе реакции падает, то солей должно быть с избытком. Растворимость медного купороса в 100 граммах воды при 25 градусах Цельсия 23 грамма. Больше 4-х кратного количества брать не советую т.к. в процессе реакции выделяется медь в виде тончайшего порошка, которая сгущает раствор солей и препятствует циркуляции раствора. Медный купорос прокаливался с целью повысить начальную температуру раствора, чтобы не ждать несколько лишних минут до начала реакции, но можно обойтись и без этого.
Деревянный шампур призван утопить сверток фольги и изолировать его от стенок бутылки. В противном случае фольга покрывается множеством пузырьков и всплывает. При этом все тепло выделяется в верхней части бутылки, что приводит к сильному разогреву и деформации стенок. В случае с шампуром, пузырьки газа заставляют жидкость циркулировать, поэтому постоянно встряхивать бутылку и выпускать газ не обязательно. Достаточно просто не закручивая пробку, дать бутылке пару минут постоять. По этому же принципу работают армейские
беспламенные нагреватели пищи.
Другая – безопасная грелка, очень интересного принципа работы в другой статье.
2 комментария
CuSO4 + 2NaCl > Na2SO4+CuCl2.
первоначальный разогрев происходит не за счет растворения сульфата мели, а за счет реакции сульфата меди и хлорида натрия.
Образующаяся хлорная медь взаимодействует с алюминием по экзотермической реакции
Кроме того, прокалить купорос и высыпать в воду, бессмысленная бредятина.
Интересно, откуда у автора статьи взялся водород.
Кроме того, надо быть полным идиотом, чтобы при проведении экзотермических реакций герметично закрывать посуду. Газы при нагревании расширяются, следовательно в емкости давление растет, а это к хорошему не приведет! Физику учить надо, бестолочь.
Автору следует записаться и походить в химический кружок во дворце пионеров
Эх, Анатолий, не надо изучать химию в кружках. Тут реакции уровня 10-го класса, и автор совершенно прав насчет водорода. Погуглите хотя бы.
Источник
Как сделать химическую грелку своими руками
В походе, на рыбалке, особенно в непогоду часто возникает нужда в обыкновенной грелке.
В походе, на рыбалке, особенно в непогоду часто возникает нужда в обыкновенной грелке. Конечно, неплоха и обычная резиновая, но у нее есть один существенный недостаток: очень уж медленно греется для нее на костре вода. Попробуем сделать химическую грелку. Для этого нам понадобятся самые обычные реактивы.
В походе, на рыбалке, особенно в непогоду часто возникает нужда обыкновенной грелке. Конечно, неплоха и обычная резиновая, но у нее есть один существенный недостаток: очень уж медленно греется для нее на костре вода.
Попробуем сделать химическую грелку. Для этого нам понадобятся самые обычные реактивы.
Для начала проведем несложный опыт. Пойдите на кухню и возьмите пачку поваренной соли. Впрочем, пачка не понадобится. Достаточно будет 20 г (2 чайных ложки). Затем загляните в шкафчик, где хранятся всевозможные хозяйственные препараты и материалы. Наверняка там сохранилось после ремонта квартиры немного медного купороса. Его понадобится 40 г (3 чайных ложки). Древесные опилки и кусок алюминиевой проволоки, надо полагать, тоже найдутся. Если так, все готово. Разотрите в ступке купорос и соль так, чтобы величина кристаллов не превышала 1мм (разумеется, на глаз). В полученную смесь добавьте 30 г (5 столовых ложек) древесных опилок и тщательно перемешайте. Кусок проволоки согните спиралью или змейкой, вложите в банку из-под майонеза. Туда же засыпьте подготовленную смесь так, чтобы уровень засыпки был на 1-1.5 см ниже горлышка банки. Грелка у вас в руках. Чтобы привести ее в действие, достаточно влить в банку 50 мл (четверть стакана) воды. Спустя 3-4 минуты температура грелки поднимется до 50-60° С.
Откуда берется в банке тепло, и какую роль играет каждый из компонентов? Обратимся к уравнению реакции:
В результате взаимодействия медного купороса с поваренной солью образуется сульфат натрия и хлорная медь. Именно она нас интересует. Если вычислить тепловой баланс реакции, то окажется, что при образовании одной грамм-молекулы хлорной меди выделяется 4700 калорий тепла. Плюс теплота растворения в исходных образующихся препаратов — 24999 калорий. Итого: примерно 29600 калорий.
Тотчас же после образования хлорная медь вступает во взаимодействие с алюминиевой проволокой:
При этом выделяется (также в пересчете на 1 г-моль хлорной меди) примерно 84000 калорий.
Как видите, в результате процесса суммарное количество выделяющегося тепла превышает 100000 калорий на каждую грамм-молекулу вещества. Так что никакой ошибки или обмана нет: грелка самая настоящая.
А что же опилки? Не принимая никакого участия в химических реакциях, они в то же время играют очень важную роль. Жадно впитывая в себя воду, опилки замедляют течение реакций, растягивают работу грелки во времени. К тому же древесина обладает достаточно низкой теплопроводностью: она как бы аккумулирует выделяющееся тепло и затем постоянно отдает его. В плотно закрытой посуде тепло сохраняется, по меньшей мере, два часа.
И последнее замечание: банка, конечно, не лучший сосуд для грелки. Она понадобилась нам только для демонстрации. Так что сами подумайте над формой и материалом для резервуара, в который поместить греющую смесь.
Источник: журнал «Юный техник», №5, 1983г., стр.78-79.
Автор: инженер Ф. Никулин.
Источник
Химическая грелка своими руками



Дата публикации: 13.04.2020 2020-04-13
Статья просмотрена: 576 раз
Библиографическое описание:
Долгополов, Е. В. Химическая грелка своими руками / Е. В. Долгополов, Т. Ф. Мамедов, Е. В. Исавнина. — Текст : непосредственный // Юный ученый. — 2020. — № 5 (35). — С. 53-55. — URL: https://moluch.ru/young/archive/35/2035/ (дата обращения: 27.09.2021).
Практически каждый ребенок зимой сталкивался с такой проблемой, как замершие руки, даже если на них надеты самые теплые варежки. Чтобы не допустить переохлаждения и обморожения можно использовать специальные грелки, которые можно приобрести на прилавках специализированных магазинов. Любители активного зимнего отдыха могут и самостоятельно изготовить грелку для рук с использованием самых простых реактивов.
Цель работы: изготовить химическую грелку своими руками.
- Узнать процесс изготовления химической грелки.
- Подобрать подходящие реактивы и емкость для изготовления грелки.
- Испытать действие химической грелки на улице в морозных условиях.
Химическая грелка — устройство очень простое [1, 2]. Обычно это емкость из водонепроницаемого и химически стойкого материала. Внутри емкости — смесь веществ (реактивы):
- Медный купорос (сульфат меди)
- Поваренная соль (хлорид натрия)
- Алюминий
Чтобы грелка начала работать, к веществам надо добавить немного воды и все перемешать. Емкость с содержимым закрывают и встряхивают. После этого необходимо открыть крышку и отставить в сторону для выхода паров. Как реакция окисления стихнет, емкость закрывается и можно греть руки. В грелке протекает химическая реакция, которая сопровождается выделением тепла. Для того, чтобы продлить работу грелки можно добавить опилки. В закрытой емкости тепло удерживается до двух часов. Чтобы использовать грелку повторно достаточно через несколько часов добавить в нее воды. Этого самодельного приспособления точно хватит для обогрева рук в течение всего времени нахождения на прогулке. После этого грелку утилизируют вместе с бытовым мусором, а отправляясь на следующую прогулку, можно быстренько соорудить новое тепловое устройство.
Для изготовления грелки для рук необходимы:
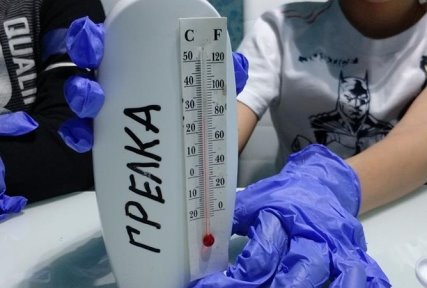
- Посуда и оборудование: флакон 200 мл.-1шт, разовые стаканчики — 2 шт, ложка-1шт, воронка- 1шт, разовая тарелка-1шт, мерный стаканчик-лейка, отвертка -1шт, термометр- 1шт.
- Реактивы: медный купорос (сульфат меди)- 40 грамм, соль поваренная (хлорид натрия)- 20 грамм, алюминиевая проволока или ложка (часть), вода — 50мл, древесные опилки-30 граммов (5 столовых ложек). Фото 1
Примечание: соли в одной столовой ложке 30 грамм, а в одной чайной ложке-10 грамм
Изготовление грелки для рук подручным способом [3] состоит из следующих шагов:
Шаг 1: Провод сворачивается спиралью, диаметр которой зависит от горлышка тары (спираль должна свободно помещаться во флакон).
Шаг 2: С помощью отвертки спираль растягивается по всей длине бутылочки.
Шаг 3: Подготавливается начинка грелки путем перемешивания соли и медного купороса.
Шаг 4: На 200 мл флакона засыпается 2 столовые ложки подготовленной смеси из медного купороса и поваренной соли.
Шаг 5: Во флакон вставляется спираль и добавляется вода.
Шаг 6: Емкость с содержимым закрывают и встряхивают. После этого необходимо открыть крышку и отставить в сторону для выхода паров.
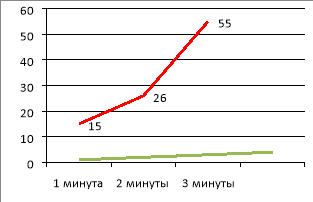
В грелке протекает химическая реакция, которая сопровождается выделением тепла. Спустя 3 минуты температура внутри грелки поднялась. При помощи термометра смогли определить температуру +55 ° С.
Рис.4. График изменения температуры
График показывает, что с каждой минутой температура росла.
Как только реакция окисления стихнет, емкость закрывается и можно греть руки. Для того, чтобы продлить работу грелки, можно добавить древесных опилок. Никакого участия в химических реакциях, они не принимают, но играют очень важную роль. Жадно впитывая в себя воду, опилки замедляют течение реакций, растягивают работу грелки во времени. В плотно закрытой посуде тепло сохраняется, по меньшей мере, два часа.
- Перед началом опыта наденьте защитные перчатки и очки.
- Соблюдайте общие правила безопасности.
- При необходимости умей оказать первую помощь.
В походных условиях грелка тоже собирается легко. Достаточно воспользоваться бутылкой, которая осталась из-под лимонада или минеральной воды. Соль, обязательно окажется в рюкзаке, ведь надо же чем-то солить пищу. От алюминиевой ложки, при необходимости можно открутить какую-то ее часть. Получается, что с собой из дома нужно захватить лишь медный купорос.
Химическую грелку для рук можно изготовить самостоятельно. Для изготовления грелки требуются вещества, которые не причиняют вред человеку. Изготовление такой грелки выгодно, так как не несет особых финансовых затрат.
- [Электронный ресурс]: http://firstfisher.ru/oborudovanie/izgotavlivaem-grelku.html
- [Электронный ресурс]: http://izobreteniya.net/opasna-li-himicheskaya-grelka-i-kak-ee-sdelat-svoimi-rukami/
Журнал «Юный техник», № 5, 1983г., стр.78–79.
Источник