Источник тока из алюминия своими руками
Перезарядка алюминиевых батарей отличается от зарядки аккумуляторов на основе лития. Но тем не менее в ней нет ничего сложного, просто нужно вставить новый алюминий, вылить электролит и налить новый электролит, все — по сути, то же самое, что и бензиновый автомобиль, только это уже электромобиль, и нет никаких нагрузок на электросети. К тому же не нужно плодить огромное количество розеток с проводами с огромным сечением, чтобы все эти электромобили зарядить.
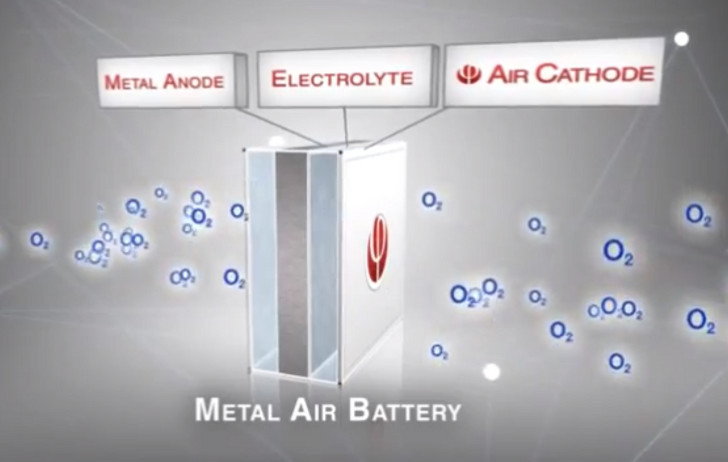
Но тут не все так гладко. Достать электричество из алюминия оказывается совсем не так просто, как хотелось бы. Сперва давайте разберемся в чем заключается принцип алюминий-воздушной батареи.
Чтобы такая батарея начала работать понадобятся 2 электрода: один естественно из алюминия, а второй — из графита. Оба эти электрода находятся в растворе электролита.
В качестве электролита можно использовать поваренную соль (NaCl), но с ней можно поднять напряжение примерно до 0,7В. Щелочным электролитом (NaOH) напряжение можно поднять уже больше, примерно до 1В.
В ходе химической реакции алюминий покрывается слоем гидроксида алюминия (Al(OH)3), который плавно опускается на дно емкости. А на поверхности электрода из графита образуются пузырьки водорода, которые в свою очередь приводят к повышению сопротивления и падению напряжения, этот процесс называется поляризацией.
Для запуска реакции щёлочи нам понадобится совсем чуть-чуть, будет достаточно 1г щёлочи на 0,5л воды.
Первым делом давайте проверим действительно ли в данной батареи нужно использовать графитовый электрод. Для опыта возьмем вот такой вот электрод из нержавеющей стали.
С данным электродом получилось напряжение 1,3В, ток короткого замыкания остановился в районе 17мА. На первый взгляд кажется, что электрод из нержавеющей стали более эффективен, но площадь поверхности нержавеющего электрода больше, так что пока неизвестно что лучше графит или нержавейка.
Так как графит имеет достаточно большое сопротивление, нужно с ним как-то бороться. Необходимо изготовить электроды из хорошо проводящего ток материала, а графит должен быть только на его поверхности. Было решено просверлить графит насквозь, и в получившихся отверстиях нарезать резьбу под болты м6.
В итоге получился стальной электрод с графитовой оболочкой.

На лицо уменьшение сопротивления, а, следовательно — эффективность конструкции возрастет. В дальнейших экспериментах будем использовать дистиллированную воду.
Первый эксперимент с электролитом, в котором 4г щелочи на 1л воды.


Даже несмотря на то, что у такая простая батарея обладает не большой отдачей по току, но зато такая батарея может работать очень долго, а в качестве электродов можно использовать любой алюминий, который легко переплавить в электроды любой формы, например, алюминиевые банки из-под различных алкогольных и безалкогольных напитков, фольга от шоколада и т.п.
В итоге, после всех проделанных экспериментах с различной концентрацией электролита, становится понятно, что при такой конструкции батареи не имеет смысла добавлять более 12г щелочи на 1 литр воды, то есть у нас получается примерно 1% раствор.
Источник
Алюминиевая батарея — отличное дополнение для электромобиля
Компания Phinergy первой в мире сумела изготовить воздушно-алюминиевую батарею, пригодную для эксплуатации в автомобиле. 100-килограммовая батарея Al-Air содержит достаточно энергии, чтобы обеспечить 3000 км хода компактного легкового автомобиля. Phinergy провела демонстрацию технологии с Citroen C1 и упрощённой версией батареи (50 пластин по 500 г, в корпусе, наполненном водой). Машина проехала 1800 км на одном заряде, останавливаясь только для пополнения запасов воды — расходуемого электролита (видео).
Алюминий не заменит литий-ионные аккумуляторы (он не заряжается от розетки), но великолепно дополняет их. Ведь 95% поездок автомобиль совершает на короткие расстояния, где достаточно стандартных аккумуляторов. Дополнительная батарея обеспечивает бэкап на случай, если аккумулятор разрядился или если нужно далеко ехать.
Воздушно-алюминиевая батарея генерирует ток за счёт химической реакции металла с кислородом из окружающего воздуха. Алюминиевая пластина — анод. С двух сторон ячейка покрыта пористым материалом с серебряным катализатором, который фильтрует CO2. Металлические элементы медленно деградируют до Al(OH)3.
Химическая формула реакции выглядит так:
Это не какая-то сенсационная новинка, а хорошо известная технология. Её давно используют военные, поскольку такие элементы обеспечивают исключительно большую плотность энергии. Но раньше инженерам никак не удавалось решить проблему с фильтрацией CO2 и сопутствующей карбонизацией. Компания Phinergy утверждает, что решила проблему и уже в 2017 году можно производить алюминиевые батареи для электромобилей (и не только для них).
Литий-ионные аккумуляторы Tesla Model S весят около 1000 кг и обеспечивают пробег 500 км (в идеальных условиях, в реальности 180-480 км). Скажем, если сократить их до 900 кг и добавить алюминиевую батарею, то масса машины не изменится. Дальность хода от аккумулятора снизится на 10-20%, зато максимальный пробег без зарядки увеличится аж до 3180-3480 км! Можно доехать от Москвы до Парижа, и ещё что-то останется.
В чём-то это похоже на концепцию гибридного автомобиля, но здесь не требуется дорогой и громоздкий двигатель внутреннего сгорания.
Недостаток технологии очевиден — воздушно-алюминиевую батарею придётся менять в сервисном центре. Наверное, раз в год или чаще. Впрочем, это вполне заурядная процедура. Компания Tesla Motors в прошлом году показывала, как аккумуляторы Model S меняют за 90 секунд (любительское видео ).
Другие недостатки — энергозатратность производства и, возможно, высокая цена. Изготовление и переработка алюминиевых батарей требует большого количества энергии. То есть с экологической точки зрения их использование только повышает общее потребление электроэнергии во всей экономике. Но зато потребление более оптимально распределяется — оно уходит из крупных городов в отдалённые районы с дешёвой энергией, там находятся ГЭС и металлургические заводы.
Неизвестно и то, сколько будут стоить такие элементы питания. Хотя сам алюминий — дешёвый металл, но катод содержит дорогое серебро. Phinergy не рассказывает, как именно изготовляет запатентованный катализатор. Возможно, это сложный техпроцесс.
Но при всех своих недостатках воздушно-алюминиевая батарея всё равно кажется очень удобным дополнением к электромобилю. По крайней мере, как временное решение на ближайшие годы (десятилетия?), пока не исчезнет проблема ёмкости аккумуляторов.
В Phinergy, тем временем, экспериментируют с «перезаряжаемой» воздушно-цинковой батареей. Она вообще работает тысячи часов без особой химической деградации, поскольку окисление цинка — обратимый процесс.
Похожие научные разработки ведутся и в России.
Источник
Хлор-алюминиевый аккумулятор
Александр Пехов – разработчик газовых аккумуляторов и топливных элементов снял видео про изготовление хлор-алюминиевого аккумулятора. На идею такой батареи автор натолкнулся случайно ходе экспериментов со сменой различных электролитов. Мысль пришла к нему в процессе зарядки на основе поваренной соли. Образуется хлор и едкий натр. Предположительно, натрий является минусом. Если залить вместо поваренной соли раствор едкого натрия, с хлором. Да, возможно что-то получится.Так и был найден способ изготовления хлор алюминиевого аккумулятора.
Первая экспериментальная модель собрана на скорую руку, но показала себя неплохо в работе. Фонарик светится уже в течении двух недель.
Что такое хлор алюминиевая батарея.
Изучая опыт других экспериментатор в интернете, мастер обнаружил разработку такой батареи, запатентованную в семидесятых годах в США.
Конструкция и работа устройства. Работает на простом домашнем отбеливателем, белизне. На таком электролите можно сделать замечательные аккумуляторы.
Алюминий в таком растворе не разрушается, за две недели образуется только кристаллики. При этом происходит заряд разряд.
Стакан, графитовый электрод, на него намотана обычная бумага. Спиралька из крученой проволоки. Блокинг-генератор в коробке из киндера. 1 элемента не потянет светодиод, поэтому нужен такой генератор.
Как собирается батарея. Заливаем белизну в стакан. Ждём, пока пропитается. Ждем, когда загорается светодиод. Это происходит практически сразу. Светодиод на 3 вольта. Какую вещь можно сделать с раствором поваренной соли. Но срок его работы будет не длительном. Отбеливатель кардинально превосходит по времени работы.
Посмотрим, сколько вольт выдает устройство. 1,5 вольта. Только 170 миллиампер.
Мастер создал аккумулятор внушительных размеров. На ночь оставляет его включенным, утром в течении 5 минут заряжают. После зарядки устройства как-бы набирает обороты. Увеличивается вольтаж. Светит и без просадки целую ночь.
Длительные эксперименты пока не проводились. Необходимо узнать, насколько только хватит зарядки, сколько нужно алюминия, раствора.
Рассмотрим, как собрана одна ячейка аккумулятора. Конечно, если взять алюминиевый и графитовые пластины большой площади, уменьшив при этом расстояние между ними, то есть поставить мембрану, залить электролитом, увеличился бы ток и получился бы замечательный мощный аккумулятор. Если алюминия расходуется, то это будет механический перезаряжаемые устройство. Если не расходуется, то это будет просто а к б.
Как собрал элементы на скорую руку?
В наличии пластмассовая трубка. Один конец запаял пробкой от пластиковой бутылки. Для герметизации силикон. На другой стороне обрезанная горлышко. Сердцевина представляет из себя графитовый стержень, на него намотана бумага. Проклеена, чтобы не размазывается. Завернуто, чтобы электролита шел только через бумагу. Сверху скручена алюминиевая пружинка. Можно одеть трубку. В идеале желательно собрать из пластин. Пока неизвестно, будет ли разрушаться алюминий. Но эксперименты, проведённых течение 5 дней показал, что алюминий сохранил свою целостную структуру. Проверка показала, что не было никаких окислившихся или разъеденных белизной мест.
Из нескольких таких пластмассовых трубок, начиненных графитом и алюминием, залитых раствором, собрана одна большая аккумуляторная батарейка. Выдает устройство в пределах 8 вольт, просадка на 3 вольта. Только небольшой. Соединение последовательное для увеличения вольтажа.
Мнение одного из подписчиков канала: это не аккумулятор, это просто, батарейка. Если тратится 0.2 ампера. 1 Ампер – это 1 кулон/секунду, 1 кулон – это – 1,6 х 10 ¹ ⁹ электронов. Т. о. За 1 секунду будет расходоваться 0.2*1,6 х 10 ¹ ⁹ = 3.2 х 10 ¹⁸ электронов. Алюминий трех валентный, т.е. в нем возможно окислить три электрона. Т.е. число атомов алюминия, окисляемые таким образом за 1 секунду = 3.2 х 10 ¹⁸/3 =1.1 х 10 ¹⁸ атомов алюминия. Вес 1 атома алюминия = 4.48 х 10 ⁻² ³ грамма. Перемножаем вес одного окисленного Аl на число окислений в секунду 1.1 х 10 ¹⁸ * 4.48 х 10 ⁻² ³ = 0.00005 грамма Al в секунду. Вывод – проволока весом 5 грамм (проволока 26 см 3 мм в диаметре) и таким током будет окисляться 5 / 0.00005 = 100000 секунд или 27 часов или около суток.
Вторая часть
Продолжение работы ведущего канала “Александр Пехов” над этим устройством. Осознан светильник, который выдает свет на хлорке, алюминии и отбеливателе. Три дня будет светить стабильно, потом нужно менять раствор, а алюминия хватит очень надолго при нагрузке одними светодиодами. В комментариях под видео автор указал, что раствор обновлять следует 1 раз в сутки.
Источник